Почему медработники часто относятся к народной медицине очень негативно? Ведь некоторые средства действительно помогают. Недостаток народных средств в том, что эффективность большинства из них не проверяется строгими научными методами, поэтому всегда остается большой риск ошибки. А ведь есть еще эффект «плацебо» — самовнушения, когда пациент убеждает себя, что лекарство действительно помогает, хотя оно может быть обычной водой из-под крана.
В прошлый раз я рассказал, какими бывают клинические исследования лекарств, а сегодня уделю основное внимание технике их проведения и оценке результатов.
Что такое протокол GCP
В отношении производства лекарств существует международный стандарт GMP (good manufacturing practise — хорошая производственная практика), а для клинических испытаний лекарств был создан стандарт GCP (good clinical practise — хорошая клиническая практика).
Каждый больной, принимающий участие в испытаниях, должен дать письменное согласие на лечение с возможным применением плацебо. Платят ли ему? Обычно нет. Пациент просто получает бесплатное лечение. Протокол исследований нового препарата должен быть обязательно одобрен Этическим комитетом каждого лечебного учреждения, в котором проводятся испытания. Зачем это надо? Здесь тонкая грань. Врач не имеет права применять плацебо у тяжелобольных, если это может закончиться трагически (например, в случае аппендицита врач обязан назначить пациенту операцию, хотя никаких сравнительных клинических исследований насчет пользы таких операций не было, а были только наблюдения хирургов, что без операции пациенты умирали). В случае развития угрожающих осложнений прием плацебо должен быть немедленно прекращен. Если пациент на любом сроке прекратил прием назначенного препарата, то он выбывает из исследования.
На каждого больного заполняется отчет в виде отдельной карты CRF (case report form), включающей оригинал и 2 копии, одна из которых остается в учреждении здравоохранения и хранится 15 лет.
Каждый исследователь должен предоставить подробную информацию о себе и обязан сразу же информировать фирму-заказчика о любых выявленных серьезных побочных эффектах. Некоторые исследования были остановлены досрочно, когда исследователи получили убедительные данные о неблагоприятных результатах лечения (например, значительный рост смертности в опытной группе). Но также бывает, что клинические испытания приостанавливаются досрочно, если выявляется огромное преимущество нового препарата или метода лечения.
Конечные точки
Чтобы оценить результаты исследования, нужно выбрать определенные параметры, которые будут оцениваться. Параметры сортируются в порядке уменьшения значимости (первичные, вторичные и третичные конечные точки).
Первичные («твердые») конечные точки — это параметры, связанные с жизнью больных и развитием угрожающих жизни осложнений. Оценивается организм в целом. Примеры:
- общая смертность,
- частота развития фатального инфаркта миокарда, инсульта, фибрилляции желудочков и т.д.
Вторичные и третичные точки называют еще «мягкими» и «суррогатными».
Вторичные конечные точки отражают состояние одной-двух систем организма:
- улучшение качества жизни из-за облегчения симптомов заболевания (например, снижение частоты приступов стенокардии),
- частота нефатального (несмертельного) инфаркта миокарда,
- снижение заболеваемости нелетальными болезнями (например, пароксизм мерцательной аритмии).
Третичные конечные точки отражают изменения отдельных параметров, например, уровня холестерина или артериального давления.
При оценке нового лекарственного средства всегда следует в первую очередь опираться на «твердые» (первичные) конечные точки. Оценка только «мягких» точек может привести к серьезным ошибкам. Наверно, поэтому точки и называют суррогатными? Примеры:
- сердечные гликозиды при хронической сердечной недостаточности повышают силу сокращений миокарда (третичная точка), уменьшают частоту госпитализаций и улучшают качество жизни (вторичные точки), но не приводят к уменьшению общей смертности (первичная точка) из-за повышенной частоты развития фатальных аритмий (тоже первичная точка);
- при СПИДе назначение некоторых препаратов, повышающих содержание T-хелперов (третичная конечная точка), не приводило к уменьшению смертности (первичной точки). Для сведения: T-хелперы — разновидность лимфоцитов, которые поражаются ВИЧ.
Мега-исследования
Чем больше качественных исследований проведено, тем достовернее результаты.
Мега-исследования (от mega — огромный) — это исследования новых лекарств более чем на 10 тысяч больных. На малых группах больных результаты не столь достоверны, поскольку в малых группах:
- трудно отличить положительный результат от лечения от спонтанных ремиссий болезни,
- трудно добиться однородности групп,
- трудно выявлять небольшие положительные сдвиги в лечении и дальнейшем прогнозе,
- трудно выявлять редкие побочные эффекты.
Иногда статистически достоверные данные мега-исследования о пользе нового препарата обусловлены наличием среди большого числа пациентов небольшой группы высокочувствительных к лечению больных. Остальным новый препарат особой пользы не приносит. Таких высокочувствительных к лечению больных нужно выявлять — т.к. максимальную пользу новый препарат принесет только им.

Схема неоднородной модели исследования
Мета-анализ
Мета-анализ (греч. meta — через) — объединение результатов нескольких контролируемых исследований по одной теме. С увеличением числа анализируемых испытаний можно обнаружить новые положительные и отрицательные эффекты лечения, не заметные в отдельных исследованиях. Мета-анализы (мета-обзоры) на сегодняшний день являются наиболее важными и ценными, потому что исследователи анализируют качество многих клинических исследований по данной теме, часть по разным причинам отбраковывают, а по оставшимся делают выводы.
Как вы должны знать к этому моменту, при чтении результатов любых исследований важно оценивать в первую очередь первичные конечные точки. Например, два мета-анализа выявили положительный антиаритмический эффект лидокаина при инфаркте миокарда, а один мета-анализ — отрицательный. Чему верить? Рекомендовать лидокаин всем подряд при инфаркте миокарда? А вот и нет, поскольку первые два мета-анализа были посвящены влиянию лидокаина на аритмии (т.е. оценке вторичных конечных точек), а третий — влиянию лидокаина на выживаемость при инфаркте миокарда (первичная конечная точка). Таким образом, лидокаин успешно подавлял аритмии, но в то же время увеличивал смертность больных.
Недостатки мета-анализов
Мета-анализы не заменяют мега-исследования и в некоторых случаях могут даже противоречить последним. Мета-анализы могут оказаться неубедительными в следующих случаях:
- если в мета-анализе дается обобщенное заключение, хотя в исследованиях участвовали неоднородные группы больных. Или же лечение начиналось в разные сроки и разными дозами препаратов;
- если эффективность лечения сравнивается в одних группах с плацебо, а в других — с известным эффективным препаратом сравнения, но вывод делается общий. Или не учитывается характер сопутствующей терапии;
- в случаях некачественной рандомизации (разделение по группам было проведено недостаточно случайно).
Результаты мета-анализов помогают врачу выбирать лечение, но они не могут быть универсальными (на все случаи жизни) и не способны заменить клинический опыт врача.
Уровни доказательности
Чтобы различать, насколько сильно можно доверять рекомендациям, были придуманы градации (А, Б, В) и уровни доказательств (1, 2, 3, 4, 5). Я собирался дать здесь эту классификацию, но при более подробном рассмотрении выяснил, что все имеющиеся у меня классификации отличались в мелочах, поскольку принимались разными организациями. По этой причине просто привожу один из примеров:

Так выглядит пример классификации уровней доказательности и градаций рекомендаций
В порядке убывания достоверности различные виды исследований располагаются в следующем порядке (источник — Шведский совет по методологии оценки в здравоохранении):
- рандомизированное контролируемое испытание (т.е. наличие опытной и контрольной группы с рандомизацией),
- нерандомизированное контролируемое исследование с одновременным контролем,
- нерандомизированное контролируемое исследование с историческим контролем,
- исследование типа «случай—контроль»,
- перекрестное контролируемое исследование, поперечное исследование,
- результаты наблюдений (открытое нерандомизированное исследование без группы),
- описание отдельных случаев.
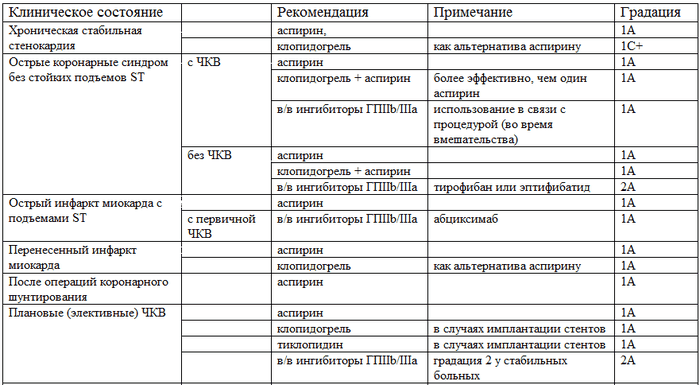
В современных рекомендациях рядом с препаратом или методом лечения указывают уровень доказательности предлагаемого лечения. Привожу пример.
Таблица.
Рекомендации по использованию антитромбоцитарных средств при различных клинических проявлениях заболеваний сосудов
Как анализировать результаты исследований
Все полученные в клиническом исследовании результаты обрабатываются с помощью методов математической статистики. Формулы и принципы расчетов довольно сложные, практическому врачу знать их точно ни к чему, а в медвузе на лечебном факультете с ними знакомятся на двух занятиях по физике на 1-м курсе и используют на социальной гигиене (организации здравоохранения) на 6-м курсе. Все расчеты организаторы клинических испытаний проводят самостоятельно с использованием пакетов статистических программ.
Обратите внимание на то, что написано дальше. Студентам и врачам нужно хорошо знать лишь две вещи:
1) Статистическую достоверность. В медицине какая-либо величина считается статистически достоверной, если она определена с вероятностью 95% или больше. Этот позволяет исключить случайные воздействия на итоговый результат.
Если вероятность оказалась меньше 95%, то нужно увеличивать число анализируемых случаев. Если увеличение выборки не помогает, то надо признать, что достоверного результата в данном случае добиться трудно.
2) Вероятность ошибки. Параметр, обозначаемый латинской буквой p (p-value).
p — вероятность ошибки в получении достоверного результата. Считается в долях от единицы. Чтобы перевести в проценты, нужно умножить на 100. В отчетах о клинических испытаниях чаще упоминаются три общепринятых значения p:
- p > 0.05 — НЕ является статически значимым (то есть вероятность ошибки больше 5%),
- p < 0.05 — является статистически значимым (вероятность ошибки 5% и меньше),
- p < 0.01 — высокая статистическая значимость (вероятность ошибки не выше 1%).
В международных рекомендациях и отчетах учитываются только статистические значимые результаты исследований, то есть те, где вероятность случайных ошибок не выше 5%. Остальные результаты отбрасываются как недостоверные.
Теперь вы в состоянии понять большую часть выводов в публикациях научных медицинских журналов. Потренируйтесь:
1)
Проведено мультицентровое рандомизированное проспективное открытое исследование со слепой оценкой конечных точек. … Получено достоверное снижение индекса чувствительности к инсулину через 16 недель лечения по сравнению с исходными значениями как в группе моксонидина (р = 0,02), так и в группе метформина (р = 0,03). Не выявлено достоверных различий по этому показателю между исследуемыми группами (р = 0,92).
Источник: моксонидин улучшает гликемический контроль у пациентов с артериальной гипертонией и избыточной массой тела в сравнении с метформином: исследование ALMAZ. Указанная ссылка является неплохим образцом описания клинического исследования. Если вас интересует эта тема — посмотрите обязательно.
Как надо понимать цитату: проводилось открытое исследование (и врач, и больной знали о том, что им назначено), что снижает ценность результата. Моксонидин и метформин продемонстрировали достоверный эффект каждый по отдельности, но ни один из препаратов не показал явного преимущества перед другим. Кроме того, индекс чувствительности к инсулину — это лишь третичная конечная точка, поэтому нужно обратить внимание и на более «твердые» точки.
2) V-HeFT II (ХНК, 804 больных, 0,5 — 5,7 лет, 1991 г.) — рандомизированное двойное слепое сравнение применения эналаприла и комбинации гидралазина с изосорбида динитратом. Достоверное снижение смертности в группе эналаприла (p = 0,016) по сравнению с группой гидралазина и изосорбида динитрата. (N Engl J Med 1991;325:303-10).
3) PRACTICAL (инфаркт миокарда, 225 больных, 12 месяцев, 1994 г.) — рандомизированное двойное слепое плацебо-контролируемое параллельное исследование. Сравнивали применение эналаприла, каптоприла и плацебо. Выживаемость на 90 день и к 1 году была достоверно выше ТОЛЬКО в группе эналаприла. Применение ингибитора АПФ (эналаприла или каптоприла) приводило к достоверному увеличению фракции выброса левого желудочка и уменьшению дилатации левого желудочка. (Am J Cardiol 1994;73:1180-6).
4) NETWORK (ХНК, 1532 больных, 6 месяцев, 1998 г.) — рандомизированное двойное слепое параллельное сравнение применения различных доз эналаприла (2,5, 5 и 10 мг двухкратно). Достоверных различий в общей и сердечно-сосудистой летальности НЕ получено. (Eur Heart J 1998;19:481-9).
Разумеется, все написанное на этой странице — лишь малая часть всей доказательной медицины, но в интернете много более подробной информации по теме.
Читайте также:
Спасибо, как обычно у Вас полная информация и разложена по полочкам.
Думаю, большая часть подведения результатов — это статистика чистой воды, поэтому нужно бы мне с ней разобраться (пока учим только статистические методы на аналитической химии).
Интересная тема. Я сама переводила научную статью с английского (участвовала в научной конференции по английскому), поэтому окунулась во все подробности, да еще и на иностранном языке… А в общем про исследования лекарств знаю хороший анекдот, который… Ах, к сожалению отражает объективную действительность.
Проведение испытаний нового препарата. Группа добровольцев.
Испытуемый обращается к врачу:
— Доктор, Вы поменяли мне препарат?
Доктор (осторожно):
— Что заставило Вас так думать?
— Понимаете, раньше, когда я выбрасывал таблетки в унитаз — они тонули. А теперь всплывают.
C’est La Vie…